Eine freie Initiative von Menschen bei mit online Lesekreisen, Übungsgruppen, Vorträgen ... |
| Use Google Translate for a raw translation of our pages into more than 100 languages. Please note that some mistranslations can occur due to machine translation. |
Elektronenpaar
Unter einem Elektronenpaar versteht man zwei Elektronen mit entgegengesetztem Spin, die dasselbe Atom- oder Molekülorbital besetzen.
Aufgrund des Pauli-Prinzips können Elektronen innerhalb eines Atoms (genauer: innerhalb eines elektronisch abgeschlossenen Systems) nicht in allen Quantenzahlen übereinstimmen. Pro Orbital, das bereits Hauptquantenzahl, Nebenquantenzahl und magnetische Quantenzahl der enthaltenen Elektronen definiert, bleibt als einziges Unterscheidungsmerkmal die Spinquantenzahl übrig, die nur die Werte +1/2 und −1/2 annehmen kann. Damit ist die maximale Zahl unterschiedlicher Elektronen pro Orbital auf zwei beschränkt.
Die Elektronen verteilen sich nach bestimmten Regeln auf die zur Verfügung stehenden Orbitale (siehe Elektronenkonfiguration oder Hundsche Regeln). Faustregel: ein neues, energetisch höher liegendes Orbital wird nur dann besetzt, wenn der Energieunterschied niedrig ist; bei größerem Unterschied werden zunächst die energieärmeren Orbitale mit einem zweiten Elektron besetzt, unter Bildung von Elektronenpaaren.
Chemische Bindung
Eine besondere Rolle spielen Elektronenpaare bei der Chemischen Bindung: die Atombindung wird durch Bindungselektronen, genauer gesagt durch bindende Elektronenpaare vermittelt, die zwischen den zwei beteiligten Atomen stehen und beiden gemeinsam sind. In den Strukturformeln werden sie meist durch einen Valenzstrich symbolisiert. Diese Art der Bindung ist neben der Ionischen und der Metallischen Bindung die wichtigste.
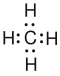
Freie Elektronenpaare (auch nichtbindende oder einsame Elektronenpaare genannt) sind nur einem Atom zugehörig und werden nach IUPAC-Empfehlung zur besseren Unterscheidbarkeit meist durch zwei Punkte dargestellt. Es gibt aber auch andere Darstellungsmöglichkeiten:
-
Wasser mit zwei Elektronenpaaren als Punkte.
-
Wasser mit zwei Elektronenpaaren als Striche.
-
Wasser mit zwei Elektronenpaaren als Elektronenwolken.
-
Ammoniak mit einem freien Elektronenpaar.
-
Stickstoffmolekül mit zwei freien Elektronenpaaren.
-
Stickstoffmolekül mit zwei Elektronenwolken.
-
Ozon mit sechs freien Elektronenpaaren.
-
Chlorwasserstoff mit drei freien Elektronenpaaren.
-
Kohlenstoffdioxid mit vier freien Elektronenpaaren.
-
Blausäure mit einem freien Elektronenpaar.
Eine Verbindung, die zumindest ein freies Elektronenpaar für eine kovalente Einfachbindung zur Verfügung stellen kann, wird als Elektronenpaardonator oder Elektronenpaardonor bezeichnet. Nach dem Lewis-Säure-Base-Konzept handelt es sich dabei um eine Lewis-Base.
Umgekehrt wirkt eine Verbindung, die wegen ihres unvollständig aufgefüllten Elektronenoktetts ein freies Elektronenpaar aufnehmen kann, als Elektronenpaarakzeptor bzw. als Lewis-Säure.
Nicht zu verwechseln damit sind die für Redoxreaktionen bedeutsamen Begriffe Elektronendonator und Elektronenakzeptor, die sich nicht auf Elektronenpaare, sondern auf einzelne Elektronen beziehen.
Siehe auch
- Elektronenpaar - Artikel in der deutschen Wikipedia
| Dieser Artikel basiert auf einer für AnthroWiki adaptierten Fassung des Artikels Elektronenpaar aus der freien Enzyklopädie de.wikipedia.org und steht unter der Lizenz Creative Commons Attribution/Share Alike. In Wikipedia ist eine Liste der Autoren verfügbar. |