Eine freie Initiative von Menschen bei mit online Lesekreisen, Übungsgruppen, Vorträgen ... |
| Use Google Translate for a raw translation of our pages into more than 100 languages. Please note that some mistranslations can occur due to machine translation. |
Isomerie: Unterschied zwischen den Versionen
imported>Odyssee |
imported>Joachim Stiller |
||
| (34 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
Von '''Isomerie''' (von {{ELSalt|ἴσος}} ''isos'' „gleich“ und {{lang|grc|μέρος}} ''meros'' „Anteil, Teil, Stück“) spricht man in der [[Chemie]], wenn die [[Molekül]]e einer [[chemische Verbindungen]] zwar aus genau den gleichen [[Atom]]en aufgebaut sind und folglich auch die gleiche [[Summenformel]] und [[Molekülmasse]] haben, sich aber durch deren Verknüpfung ('''Strukturisomerie''' bzw. '''Konstititionsisomerie''') und/oder räumlicher Anordnung ('''Stereoisomerie''') unterscheiden. Derartige Verbindungen werden als '''Isomere''' bezeichnet. | Von '''Isomerie''' (von {{ELSalt|ἴσος}} ''isos'' „gleich“ und {{lang|grc|μέρος}} ''meros'' „Anteil, Teil, Stück“) spricht man in der [[Chemie]], wenn die [[Molekül]]e einer [[chemische Verbindungen]] zwar aus genau den gleichen [[Atom]]en aufgebaut sind und folglich auch die gleiche [[Summenformel]] und [[Molekülmasse]] haben, sich aber durch deren Verknüpfung ('''Strukturisomerie''' bzw. '''Konstititionsisomerie''') und/oder räumlicher Anordnung ('''Stereoisomerie''') unterscheiden. Derartige Verbindungen werden als '''Isomere''' bezeichnet. | ||
Atome sind nach [[Rudolf Steiner]] ''[[struktur]]ell'' als ''[[idee]]lle'' [[Raum]]inhalte aufzufassen; das Inhaltliche ist das Ergebnis einander begegnender Kräfterichtungen {{GZ||320|192}}. Moleküle sind komplexere [[gestalt]]bildende Kräftebegegnungen, die durch entsprechende [[Strukturformel]]n veranschaulicht werden können. | Atome sind nach [[Rudolf Steiner]] ''[[struktur]]ell'' als ''[[idee]]lle'' [[Raum]]inhalte aufzufassen; das Inhaltliche ist das Ergebnis einander begegnender Kräfterichtungen {{GZ||320|192}}. Moleküle sind komplexere [[gestalt]]bildende Kräftebegegnungen, die durch entsprechende [[Strukturformel]]n veranschaulicht werden können. [[Kraft]] wird dabei als einseitig räumliche ([[luziferisch]]e<ref>vgl. dazu Rudolf Steiner: ''Menschliche und menschheitliche Entwicklungswahrheiten. Das Karma des Materialismus.'', [[GA 176]] (1982), ISBN 3-7274-1760-9, {{GG|176|239f}}</ref>) Offenbarung des [[Geist]]es verstanden. | ||
== Konstitutionsisomerie == | == Konstitutionsisomerie == | ||
'''Konstitutionsisomere''' (auch '''Strukturisomere''' genannt) unterscheiden sich bei gleicher [[Summenformel]] durch ihre [[Konstitution (Chemie)|Konstitution]], d.h. durch die Reihenfolge der an ihrem Aufbau beteiligten [[Atom]]e und ihrer [[Chemische Bindung|Bindungen]]. Sie haben dadurch in der Regel auch unterschiedliche [[Chemie|chemische]] und [[physik]]alische Eigenschaften (Schmelzpunkt, Siedepunkt, Löslichkeit, etc.). | '''Konstitutionsisomere''' (auch '''Strukturisomere''' genannt) unterscheiden sich bei gleicher [[Summenformel]] durch ihre [[Konstitution (Chemie)|Konstitution]], d.h. durch die Reihenfolge der an ihrem Aufbau beteiligten [[Atom]]e und ihrer [[Chemische Bindung|Bindungen]]. Sie haben dadurch in der Regel auch unterschiedliche [[Chemie|chemische]] und [[physik]]alische Eigenschaften (Schmelzpunkt, Siedepunkt, Löslichkeit, etc.). | ||
{{Anker|Skelettisomerie}} | {{Anker|Skelettisomerie}} | ||
'''Skelettisomere''' treten vor allem bei [[Kohlenwasserstoffe]]n und davon abgeleiteten Verbindungen auf. Sie bilden bei gleicher Anzahl von [[Kohlenstoff]]atomen unterschiedlich verzweigte [[Kohlenstoffkette]]n. Bei den [[w:Butane|Butanen]], deren Gerüst aus 4 Kohlenstoffatomen besteht, ergeben sich beispielsweise rein kombinatorisch zwei Anordnungsmöglichkeiten, bei den [[w:Pentane|Pentanen]] mit 5 C-Atomen bereits 3, bei den [[w:Hexane|Hexanen]] mit 6 C-Atomen 5 Möglichkeiten usw. Mit steigender Anzahl an Kohlenstoffatomen wächst die Zahl möglicher Isomere sehr rasch an, woraus sich praktisch unbegrenzte Gestaltungsmöglichkeiten ergeben. | |||
{| class="wikitable" style="margin-left:20px; text-align:center; font-size:90%" | {| class="wikitable" style="margin-left:20px; text-align:center; font-size:90%" | ||
|- | |- | ||
! align="center" colspan=" | ! Verbindung | ||
! align="center" colspan="2"| Butane | |||
! align="center" colspan="3"| Pentane | |||
|- | |- | ||
| align="left" | Name | | align="left" | Name | ||
| ''n''-Pentan || Isopentan || Neopentan | | ''n''-Butan || Isobutan || ''n''-Pentan || Isopentan || Neopentan | ||
|- | |- | ||
| align="left" | Andere Namen | | align="left" | Andere Namen | ||
| - | |||
| 2-Methylpropan | |||
| - | | - | ||
| 2-Methylbutan | | 2-Methylbutan | ||
| Zeile 24: | Zeile 29: | ||
|- | |- | ||
| align="left" | [[Strukturformel]] | | align="left" | [[Strukturformel]] | ||
| [[Datei:Butan Skelett.svg|100px]] | |||
| [[Datei:Isobutan 1.svg|80px]] | |||
| [[Datei:Pentan Skelett.svg|110px]] | | [[Datei:Pentan Skelett.svg|110px]] | ||
| [[Datei:Isopentan.svg|100 px]] | | [[Datei:Isopentan.svg|100 px]] | ||
| Zeile 29: | Zeile 36: | ||
|- | |- | ||
| align="left" | [[Summenformel]] | | align="left" | [[Summenformel]] | ||
| colspan="2" | C<sub>4</sub>H<sub>10</sub> | |||
| colspan="3" | C<sub>5</sub>H<sub>12</sub> | | colspan="3" | C<sub>5</sub>H<sub>12</sub> | ||
|- | |- | ||
| align="left" | [[w:Schmelzpunkt|Schmelzpunkt]] | | align="left" | [[w:Schmelzpunkt|Schmelzpunkt]] | ||
| −138,29 °C | |||
| −159,42 °C | |||
| −130 °C | | −130 °C | ||
| −160 °C | | −160 °C | ||
| Zeile 37: | Zeile 47: | ||
|- | |- | ||
| align="left" | [[w:Siedepunkt|Siedepunkt]] | | align="left" | [[w:Siedepunkt|Siedepunkt]] | ||
| 36 °C || 28 °C || 9,5 °C | | −0,50 °C || −11,7 °C || 36 °C || 28 °C || 9,5 °C | ||
|- | |- | ||
| align="left" | [[Dichte]] | | align="left" | [[Dichte]] | ||
| 0,63 g·cm<sup>−3</sup> || 0,62 g·cm<sup>−3</sup> || 0,6135 g·cm<sup>−3</sup> | | 0,59 kg·l<sup>−1</sup> || 0,60 kg·l<sup>−1</sup> || 0,63 g·cm<sup>−3</sup> || 0,62 g·cm<sup>−3</sup> || 0,6135 g·cm<sup>−3</sup> | ||
|} | |} | ||
{{Anker|Funktionsisomere}} | {{Anker|Funktionsisomere}} | ||
'''Funktionsisomere''' besitzen unterschiedliche [[Funktionelle Gruppe|funktionelle Gruppen]]. '''Stellungsisomere''' tragen die ''gleiche'' funktionelle Gruppe an unterschiedlichen Kohlenstoffatomen. | |||
{| class="wikitable" style="margin-left:20px; text-align:center; font-size:90%" | {| class="wikitable" style="margin-left:20px; text-align:center; font-size:90%" | ||
|- | |- | ||
! align="center" colspan=" | ! align="left" | Verbindung | ||
! align="center" colspan="2"| Funktionsisomere | |||
! align="center" colspan="2"| Stellungssisomere | |||
|- | |- | ||
| align="left" | Name | | align="left" | Name | ||
| [[Ethanol]] || [[w:Dimethylether|Dimethylether]] | | [[Ethanol]] || [[w:Dimethylether|Dimethylether]] || [[w:1-Propanol|1-Propanol]] || [[w:2-Propanol|2-Propanol]] | ||
|- | |- | ||
| align="left" | Andere Namen | | align="left" | Andere Namen | ||
| Ethylalkohol | | Ethylalkohol | ||
| Methoxymethan | | Methoxymethan | ||
| ''n''-Propanol | |||
| Isopropanol | |||
|- | |- | ||
| align="left" | [[Strukturformel]] | | align="left" | [[Strukturformel]] | ||
| [[Datei:Ethanol Skelett.svg| | | [[Datei:Ethanol Skelett.svg|90px]] | ||
| [[Datei:Dimethyl ether Structural Formulae.svg| | | [[Datei:Dimethyl ether Structural Formulae.svg|90px]] | ||
| [[Datei:Propan-1-ol Skelett.svg|90px]] | |||
|[[Datei:2-Propanol2.svg|90px]] | |||
|- | |- | ||
| align="left" | [[Summenformel]] | | align="left" | [[Summenformel]] | ||
| colspan="2" | C<sub>2</sub>H<sub>6</sub>O | | colspan="2" | C<sub>2</sub>H<sub>6</sub>O | ||
| colspan="2" | C<sub>3</sub>H<sub>8</sub>O | |||
|- | |- | ||
| align="left" | [[w:Schmelzpunkt|Schmelzpunkt]] | | align="left" | [[w:Schmelzpunkt|Schmelzpunkt]] | ||
| −114,5 °C | | −114,5 °C | ||
| −141,5 °C | | −141,5 °C | ||
| −126 °C | |||
| −88 °C | |||
|- | |- | ||
| align="left" | [[w:Siedepunkt|Siedepunkt]] | | align="left" | [[w:Siedepunkt|Siedepunkt]] | ||
| 78,32 °C | | 78,32 °C | ||
| −24,8 °C | |||
| 97 °C | |||
| 82 °C | |||
|- | |- | ||
| align="left" | [[Dichte]] | | align="left" | [[Dichte]] | ||
| 0,7893 g·cm<sup>−3</sup> || 0,7354 g·cm<sup>−3</sup> <small>(der Flüssigkeit beim Siedepunkt)</small><br | | 0,7893 g·cm<sup>−3</sup> | ||
| align="left" | 0,7354 g·cm<sup>−3</sup> <small>(der Flüssigkeit beim Siedepunkt)</small><br>2,1146 kg·m<sup>−3</sup> <small>(Gasdichte bei 0 °C, 1013 hPa) | |||
| 0,80 g·cm<sup>−3</sup> | |||
| 0,78 g·cm<sup>−3</sup> | |||
|} | |||
{{Anker|Bindungsisomere}} | |||
'''Bindungsisomere''' unterscheiden sich durch die Anzahl und/oder Anordung der [[Einfachbindung|Einfach]]- und [[Mehrfachbindung|Mehrfachbindungen]] innerhalb des Moleküls, wie es etwa das Beispiel der [[w:Butadien|Butadiene]] und [[w:Butine|Butine]] zeigt: | |||
{| class="wikitable" style="margin-left:20px; text-align:center; font-size:90%" | |||
|- | |||
! align="left" | Verbindung | |||
! align="center" colspan="2"| Butadiene | |||
! align="center" colspan="2"| Butine | |||
|- | |||
| align="left" | Name | |||
| [[w:1,2-Butadien|1,2-Butadien]] | |||
| [[w:1,3-Butadien|1,3-Butadien]] | |||
| [[w:1-Butin|1-Butin]] | |||
| [[w:2-Butin|2-Butin]] | |||
|- | |||
| align="left" | Andere Namen | |||
| - | |||
| - | |||
| Ethylacetylen | |||
| Dimethylacetylen | |||
|- | |||
| align="left" | [[Strukturformel]] | |||
| [[Datei:Buta-1,2-dien.svg|110px]] | |||
| [[Datei:Buta-1,3-diene 200.svg|100px]] | |||
| [[Datei:Ethylacetylene.svg|130px]] | |||
| [[Datei:Dimethylacetylene.png|100px]] | |||
|- | |- | ||
| align="left" | [[ | | align="left" | [[Summenformel]] | ||
| | | colspan="4" | C<sub>2</sub>H<sub>6</sub> | ||
|} | |} | ||
== Stereoisomerie == | == Stereoisomerie == | ||
'''Stereoisomere''' haben die gleiche Konsitution, unterscheiden sich aber durch ihre [[Konfiguration (Chemie)|Konfiguration]], d.h. durch die [[ | '''Stereoisomere''' haben die gleiche [[Konstitution (Chemie)|Konsitution]], unterscheiden sich aber durch die [[dreidimensional]]e räumliche Anordnung der Atome. | ||
=== Konfigurationsisomerie === | |||
'''Konfigurationsisomere''' unterscheiden sich durch ihre [[Konfiguration (Chemie)|Konfiguration]]. Die [[Konformation]], die die verschiedenen räumlichen Anordnungen beschreibt, die sich durch Drehungen um Einfachbindungen ergeben, bleibt dabei unberücksichtigt. | |||
==== Enantiomerie ==== | |||
[[Datei:Milchsäure Enantiomerenpaar.svg|mini|300px|Struktur der beiden Enantiomere von [[w:Milchsäure|Milchsäure]]<br />Links: (''S'')-Milchsäure, rechts: (''R'')-Milchsäure]] | |||
'''Enantiomere''' (von {{ELSalt|ἐνάντιος}} ''enantios'' „Gegenstück“ und {{lang|grc|μέρος}} ''méros'' „Teil“) sind Konfigurationsisomere, die sich zueinander wie Bild und Spiegelbild verhalten und das Molekül über keine Symmetrieebene verfügt, weshalb man auch von '''Spiegelbildisomerie''' spricht. Da die beiden Enantiomere so wie die linke und rechte Hand nicht zur Deckung gebracht werden können, bezeichnet man die '''Enantiomerie''' auch als '''Chiralität''' („Händigkeit“, von {{ELSalt|χείρ}} ''ch[e]ir'' „[[Hand]]“). Ein Molekül ist genau dann ''chiral'', wenn es keine [[Drehspiegelung|Drehspiegelachse]] besitzt; andere Formen der [[Symmetrie]] können aber durchaus vorliegen. Eine 1:1-Mischung der beiden Enantiomere wird als '''Racemat''' bezeichnet. Der Name leitet sich von der [[w:Traubensäure|Traubensäure]] ([[lat.]] ''acidum racemicum'') ab, die ein racemisches Gemisch der beiden Enantiomere der [[w:Weinsäure|Weinsäure]] ist. Bei ihr gelang [[w:Louis Pasteur|Louis Pasteur]] 1848 erstmals die '''Racematspaltung''', d.h. die Trennung zweier Enantiomerer, durch mühsames Aussortieren aufgrund ihrer spiegelbildlichen Kristallformen. | |||
Ausgenommen ihrer [[Optische Aktivität|optischen Aktivität]] haben Enantiomere die gleichen [[physik]]alischen Eigenschaften wie [[Schmelzpunkt]], [[Siedepunkt]], [[Dichte]], [[Spektrum|spektrale Eigenschaften]] usw. Sie unterscheiden sich aber deutlich in ihren [[Biochemie|biochemischen]] und [[Physiologie|physiologischen]] Wirkungen. Viele [[Biologie|biologisch]] aktive [[Chemische Verbindung|Verbindungen]] sind chiral, wobei in der Natur meist eines der beiden Enantiomere bevorzugt wird. So liegen etwa die meisten natürlichen [[Aminosäuren]] in der L-Form vor, während bei den [[Kohlenhydrate|Zuckern]] die D-Form überwiegt. | |||
==== Diastereomerie ==== | |||
Als '''Diastereomere''' bezeichnet man zusammenfassend alle Konfigurationsisomere, die ''keine'' Enantiomere sind, also keine Spiegelbildisomerie zeigen. | |||
=== Konformationsisomerie === | |||
'''Konformationsisomere''' (kurz: '''Konformere''') unterscheiden sich durch ihre [[Konformation]]. Sie lassen sich durch Drehungen um [[Einfachbindung]]en ineinander überführen. | |||
== Siehe auch == | == Siehe auch == | ||
| Zeile 90: | Zeile 159: | ||
== Literatur == | == Literatur == | ||
* Rudolf Steiner: ''Geisteswissenschaftliche Impulse zur Entwickelung der Physik, I'', [[GA 320]] (2000), ISBN 3-7274-3200-4 {{Vorträge|320}} | * [[Rudolf Steiner]]: ''Geisteswissenschaftliche Impulse zur Entwickelung der Physik, I'', [[GA 320]] (2000), ISBN 3-7274-3200-4 {{Vorträge|320}} | ||
{{GA}} | {{GA}} | ||
== Einzelnachweise == | |||
<references /> | |||
[[Kategorie:Chemie]] | [[Kategorie:Chemie]] | ||
{{Wikipedia}} | |||
Aktuelle Version vom 30. März 2020, 11:42 Uhr

Von Isomerie (von griech. ἴσος isos „gleich“ und μέρος meros „Anteil, Teil, Stück“) spricht man in der Chemie, wenn die Moleküle einer chemische Verbindungen zwar aus genau den gleichen Atomen aufgebaut sind und folglich auch die gleiche Summenformel und Molekülmasse haben, sich aber durch deren Verknüpfung (Strukturisomerie bzw. Konstititionsisomerie) und/oder räumlicher Anordnung (Stereoisomerie) unterscheiden. Derartige Verbindungen werden als Isomere bezeichnet.
Atome sind nach Rudolf Steiner strukturell als ideelle Rauminhalte aufzufassen; das Inhaltliche ist das Ergebnis einander begegnender Kräfterichtungen (Lit.: GA 320, S. 192). Moleküle sind komplexere gestaltbildende Kräftebegegnungen, die durch entsprechende Strukturformeln veranschaulicht werden können. Kraft wird dabei als einseitig räumliche (luziferische[1]) Offenbarung des Geistes verstanden.
Konstitutionsisomerie
Konstitutionsisomere (auch Strukturisomere genannt) unterscheiden sich bei gleicher Summenformel durch ihre Konstitution, d.h. durch die Reihenfolge der an ihrem Aufbau beteiligten Atome und ihrer Bindungen. Sie haben dadurch in der Regel auch unterschiedliche chemische und physikalische Eigenschaften (Schmelzpunkt, Siedepunkt, Löslichkeit, etc.).
Skelettisomere treten vor allem bei Kohlenwasserstoffen und davon abgeleiteten Verbindungen auf. Sie bilden bei gleicher Anzahl von Kohlenstoffatomen unterschiedlich verzweigte Kohlenstoffketten. Bei den Butanen, deren Gerüst aus 4 Kohlenstoffatomen besteht, ergeben sich beispielsweise rein kombinatorisch zwei Anordnungsmöglichkeiten, bei den Pentanen mit 5 C-Atomen bereits 3, bei den Hexanen mit 6 C-Atomen 5 Möglichkeiten usw. Mit steigender Anzahl an Kohlenstoffatomen wächst die Zahl möglicher Isomere sehr rasch an, woraus sich praktisch unbegrenzte Gestaltungsmöglichkeiten ergeben.
| Verbindung | Butane | Pentane | |||
|---|---|---|---|---|---|
| Name | n-Butan | Isobutan | n-Pentan | Isopentan | Neopentan |
| Andere Namen | - | 2-Methylpropan | - | 2-Methylbutan | 2,2-Dimethylpropan |
| Strukturformel | 
|

| |||
| Summenformel | C4H10 | C5H12 | |||
| Schmelzpunkt | −138,29 °C | −159,42 °C | −130 °C | −160 °C | −16,6 °C |
| Siedepunkt | −0,50 °C | −11,7 °C | 36 °C | 28 °C | 9,5 °C |
| Dichte | 0,59 kg·l−1 | 0,60 kg·l−1 | 0,63 g·cm−3 | 0,62 g·cm−3 | 0,6135 g·cm−3 |
Funktionsisomere besitzen unterschiedliche funktionelle Gruppen. Stellungsisomere tragen die gleiche funktionelle Gruppe an unterschiedlichen Kohlenstoffatomen.
| Verbindung | Funktionsisomere | Stellungssisomere | ||
|---|---|---|---|---|
| Name | Ethanol | Dimethylether | 1-Propanol | 2-Propanol |
| Andere Namen | Ethylalkohol | Methoxymethan | n-Propanol | Isopropanol |
| Strukturformel | 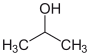
| |||
| Summenformel | C2H6O | C3H8O | ||
| Schmelzpunkt | −114,5 °C | −141,5 °C | −126 °C | −88 °C |
| Siedepunkt | 78,32 °C | −24,8 °C | 97 °C | 82 °C |
| Dichte | 0,7893 g·cm−3 | 0,7354 g·cm−3 (der Flüssigkeit beim Siedepunkt) 2,1146 kg·m−3 (Gasdichte bei 0 °C, 1013 hPa) |
0,80 g·cm−3 | 0,78 g·cm−3 |
Bindungsisomere unterscheiden sich durch die Anzahl und/oder Anordung der Einfach- und Mehrfachbindungen innerhalb des Moleküls, wie es etwa das Beispiel der Butadiene und Butine zeigt:
| Verbindung | Butadiene | Butine | ||
|---|---|---|---|---|
| Name | 1,2-Butadien | 1,3-Butadien | 1-Butin | 2-Butin |
| Andere Namen | - | - | Ethylacetylen | Dimethylacetylen |
| Strukturformel | 
|

|
||
| Summenformel | C2H6 | |||
Stereoisomerie
Stereoisomere haben die gleiche Konsitution, unterscheiden sich aber durch die dreidimensionale räumliche Anordnung der Atome.
Konfigurationsisomerie
Konfigurationsisomere unterscheiden sich durch ihre Konfiguration. Die Konformation, die die verschiedenen räumlichen Anordnungen beschreibt, die sich durch Drehungen um Einfachbindungen ergeben, bleibt dabei unberücksichtigt.
Enantiomerie

Links: (S)-Milchsäure, rechts: (R)-Milchsäure
Enantiomere (von griech. ἐνάντιος enantios „Gegenstück“ und μέρος méros „Teil“) sind Konfigurationsisomere, die sich zueinander wie Bild und Spiegelbild verhalten und das Molekül über keine Symmetrieebene verfügt, weshalb man auch von Spiegelbildisomerie spricht. Da die beiden Enantiomere so wie die linke und rechte Hand nicht zur Deckung gebracht werden können, bezeichnet man die Enantiomerie auch als Chiralität („Händigkeit“, von griech. χείρ ch[e]ir „Hand“). Ein Molekül ist genau dann chiral, wenn es keine Drehspiegelachse besitzt; andere Formen der Symmetrie können aber durchaus vorliegen. Eine 1:1-Mischung der beiden Enantiomere wird als Racemat bezeichnet. Der Name leitet sich von der Traubensäure (lat. acidum racemicum) ab, die ein racemisches Gemisch der beiden Enantiomere der Weinsäure ist. Bei ihr gelang Louis Pasteur 1848 erstmals die Racematspaltung, d.h. die Trennung zweier Enantiomerer, durch mühsames Aussortieren aufgrund ihrer spiegelbildlichen Kristallformen.
Ausgenommen ihrer optischen Aktivität haben Enantiomere die gleichen physikalischen Eigenschaften wie Schmelzpunkt, Siedepunkt, Dichte, spektrale Eigenschaften usw. Sie unterscheiden sich aber deutlich in ihren biochemischen und physiologischen Wirkungen. Viele biologisch aktive Verbindungen sind chiral, wobei in der Natur meist eines der beiden Enantiomere bevorzugt wird. So liegen etwa die meisten natürlichen Aminosäuren in der L-Form vor, während bei den Zuckern die D-Form überwiegt.
Diastereomerie
Als Diastereomere bezeichnet man zusammenfassend alle Konfigurationsisomere, die keine Enantiomere sind, also keine Spiegelbildisomerie zeigen.
Konformationsisomerie
Konformationsisomere (kurz: Konformere) unterscheiden sich durch ihre Konformation. Sie lassen sich durch Drehungen um Einfachbindungen ineinander überführen.
Siehe auch
Literatur
- Rudolf Steiner: Geisteswissenschaftliche Impulse zur Entwickelung der Physik, I, GA 320 (2000), ISBN 3-7274-3200-4 pdf pdf(2) html mobi epub archive.org English: rsarchive.org
 Literaturangaben zum Werk Rudolf Steiners folgen, wenn nicht anders angegeben, der Rudolf Steiner Gesamtausgabe (GA), Rudolf Steiner Verlag, Dornach/Schweiz Email: verlag@steinerverlag.com URL: www.steinerverlag.com.
Freie Werkausgaben gibt es auf steiner.wiki, bdn-steiner.ru, archive.org und im Rudolf Steiner Online Archiv. Eine textkritische Ausgabe grundlegender Schriften Rudolf Steiners bietet die Kritische Ausgabe (SKA) (Hrsg. Christian Clement): steinerkritischeausgabe.com Die Rudolf Steiner Ausgaben basieren auf Klartextnachschriften, die dem gesprochenen Wort Rudolf Steiners so nah wie möglich kommen. Hilfreiche Werkzeuge zur Orientierung in Steiners Gesamtwerk sind Christian Karls kostenlos online verfügbares Handbuch zum Werk Rudolf Steiners und Urs Schwendeners Nachschlagewerk Anthroposophie unter weitestgehender Verwendung des Originalwortlautes Rudolf Steiners. |
Einzelnachweise
- ↑ vgl. dazu Rudolf Steiner: Menschliche und menschheitliche Entwicklungswahrheiten. Das Karma des Materialismus., GA 176 (1982), ISBN 3-7274-1760-9, S. 239f
| Dieser Artikel basiert auf einer für AnthroWiki adaptierten Fassung des Artikels Isomerie aus der freien Enzyklopädie de.wikipedia.org und steht unter der Lizenz Creative Commons Attribution/Share Alike. In Wikipedia ist eine Liste der Autoren verfügbar. |








